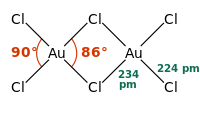三氯化金
| 三氯化金 | |
|---|---|
 | |
 | |
IUPAC名 Gold(III) chloride 氯化金 (III) | |
| 英文名 | Gold (III) chloride |
| 别名 | 氯化金 三氯化金 |
| 识别 | |
CAS号 | 13453-07-1 |
PubChem | 26030 |
ChemSpider | 24244 |
SMILES |
|
InChI |
|
InChIKey | RJHLTVSLYWWTEF-DFZHHIFOAC |
ChEBI | 30076 |
RTECS | MD5420000 |
| 性质 | |
化学式 | AuCl3 (实际上為双聚体Au2Cl6) |
摩尔质量 | 303.325 (無水) g·mol⁻¹ |
| 外观 | 紅色晶体 |
密度 | 3.9 g/cm3(固體) |
熔点 | 254℃(527 K)(分解) |
溶解性(水) | 68 g/100 ml(冷) |
溶解性(乙醇、乙醚) | 可溶 |
| 结构 | |
晶体结构 | 單斜晶系 |
| 危险性 | |
| 主要危害 | 刺激性 |
NFPA 704 |  0 1 0 |
| 相关物质 | |
| 其他阴离子 | 三氟化金 三溴化金 |
| 其他阳离子 | 一氯化金 氯化銀 二氯化鉑 氯化汞 |
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
三氯化金,俗稱氯化金,是最常见的無機金化合物,化學式是AuCl3。名称中的羅馬數字表明金的化合价為+3,這是它眾多化合物中最為穩定的价态。金亦會形成另一種氯化物——氯化亚金(AuCl),它没有AuCl3穩定。另外,把金溶於王水便會產生氯金酸,有時也會非正式地稱為:「氯化金」、「三氯合金酸」或是「三水合氯化金(III)」[來源請求]。
氯化金(III)吸濕性很强,极易溶於水及乙醇。溫度高於160 °C或光照時會分解,並產生多種有大量配体的配合物。
目录
1 結構
2 化學性质
3 製備
4 用途
5 注意事项
6 參考資料
結構
固態和气态的三氯化金都是二聚物;金的溴化物——AuBr3也是如此。兩個Au分別位於兩個正方平面的中心。此結構稱為平面型結構[1] ,AlCl3及FeCl3也屬於這個結構。AuCl3中的化学键主要是共价的,反映了它[谁?]的高化合价和相對高的电负性。
化學性质
無水AuCl3在160℃左右分解為AuCl。但后者更高溫時會发生歧化反应,生成金屬金及AuCl3。
- AuCl3 → AuCl + Cl2 (>160℃)
- 3AuCl → AuCl3 + 2Au (>420℃)
AuCl3是一种路易斯酸,可生成多種加合物,例如:與盐酸反應生成氯金酸(HAuCl4):
- HCl(aq) + AuCl3(aq) → H+ + AuCl4(aq)−
三氯化金的水溶液極易與其它金屬反應置換出金屬金,包括鉀、鈉等活性大的金屬,原因是金的活性序排在很後面(比氫還後面),因此只要排在它前面都能與它置換,例如鎂、鋁、銅反應式為:
2AuCl3 + 3Mg → 3MgCl2 + 2Au
AuCl3 + Al → AlCl3 + Au
2AuCl3 + 3Cu → 3CuCl2 + 2Au
一些氯化物,例如氯化鉀也會与AuCl3反應,生成AuCl4−。
AuCl3溶液與鹼(例如氫氧化鈉)反應,生成不純的Au(OH)3沉澱,此沉淀溶於過量的氫氧化鈉中生成金酸鈉NaAuO2。Au(OH)3受热时,會分解成氧化金(Au2O3),再进一步分解成金屬金。[2][3][4][5][6][7]
製備
最常用的製備氯化金(III)的方法,是直接在高溫中氯化该金屬:
- 2Au + 3Cl2 → 2AuCl3
用途
三氯化金是最常见的金化合物之一,因此常用作合成许多其他金化合物的起始點。例如:溶于水的氰化物配合物——KAu(CN)4:
- AuCl3 + 4KCN → KAu(CN)4 + 3KCl
金(III)鹽,特別是NaAuCl4(由AuCl3与NaCl反应製得),可取代有毒的汞(II)鹽作為炔烴反應的催化劑。例如,通过終端炔烴的水合作用来制备甲基酮:[8]
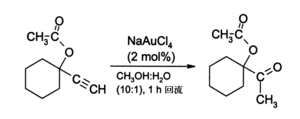
一般在這些条件下,酮的產量可達90%。还有一個用途是在炔烴的胺化反应中作為催化劑。
近年,AuCl3開始引起有機化學家的青睐,因为它可作為其他化學反應的弱酸性催化劑,例如:芳香烴的烷基化反应,以及把呋喃轉換成苯酚(見下)。在有機物的合成以及在制藥工业中也會用到此化學反應。例如:2-甲基呋喃(斯而烷)可在第5位置与甲基乙烯基酮顺利发生烷基化反应:

常溫下,用甲基腈中1 mole%的AuCl3只需進行40分鐘的反應便可產生91%的產物。這個產量值得注意,因為呋喃和酮通常在酸性環境下极易发生聚合反应等的副反应。有時当炔烴存在时,会生成苯酚:[9]
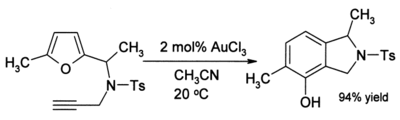
此反應中,碳原子经历了一系列複雜的重排,产生新的芳香環。[10]
注意事项
處理三氯化金時應戴上手套及護目鏡,避免直接接觸物料。
參考資料
^ Egon Wiberg; Nils Wiberg; A. F. Holleman. Inorganic Chemistry 101. Academic Press. 2001: 1286–1287. ISBN 0123526515.
^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
^ Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990
^ The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960
^ H. Nechamkin, The Chemistry of the Elements), McGraw-Hill, New York, 1968
^ A. F. Wells, Structural Inorganic Chemistry , 5th ed., Oxford University Press, Oxford, UK, 1984
^ G. Dyker, An Eldorado for Homogeneous Catalysis? , in Organic Synthesis Highlights V, H.-G. Schmaltz, T. Wirth (eds.), pp 48-55, Wiley-VCH, Weinheim, 2003
^ Y. Fukuda, K. Utimoto, J. Org. Chem. 56, 3729-3731 (1991)
^ A. S. K. Hashmi, T. M. Frost, J. W. Bats, J. Am. Chem. Soc. 122, 11553-11554 (2000)
^ Hashmi, A. S. K.; Rudolph, M.; Weyrauch, J. P.; Wölfle, M.; Frey, W.; Bats, J. W. Angew. Chem. Int. Ed. 2005, 44, 2798-2801
| ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||