胰腺癌
body.skin-minerva .mw-parser-output table.infobox caption{text-align:center}
| 胰臟癌 | |
|---|---|
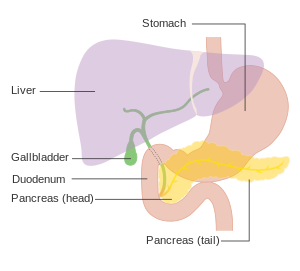 | |
胰臟位置示意圖。此圖的胰臟位於胃後方,圖中橘色的為胃,黃色的為胰臟,紫色的為肝臟,綠色的為膽囊和膽管。 | |
| 醫學專科 | 肿瘤学 |
| 症状 | 黄疸、腹痛、背痛、體重不明原因下降、淺色糞便、深色尿、食欲不振[1] |
| 常見始發於 | 40歲以上[2] |
| 風險因子 | 吸菸、肥胖症、糖尿病,罕見遺傳因子[2] |
| 診斷方法 | 影像學、血液檢查、組織切片[3][4] |
| 預防 | 戒菸、維持健康體重、減少食用紅肉[5] |
| 治療 | 手術、放射線療法、化学疗法、和缓医疗[1] |
| 預後 | 五年存活率 5%[6][7] |
| 盛行率 | 393,800(2015年)[8] |
| 死亡數 | 411,600(2015年)[9] |
胰臟癌(英语:pancreatic cancer)是指胰臟細胞發生癌變而產生的腫瘤,這些腫瘤細胞具有侵犯其他組織的能力[10]。胰臟的癌症可分為許多類型[6],最常見的是胰臟腺癌(pancreatic adenocarcinoma),佔了85%,因此胰臟癌一詞有時也用來直接指稱胰臟腺癌[6],這些腺癌發源於胰臟製造消化酶的部位[6];該部位也可能發生其他幾種通稱為非腺癌(non-adenocarcinomas)的癌症[6]。另外1-2%的病例為來自神經內分泌細胞的神經內分泌腫瘤[6],這類癌症的侵襲性通常沒有胰臟腺癌強[6]。
胰臟癌最常見的症狀和徵象包括黄疸、腹痛或背痛、不明原因的體重減輕、淺色糞便、茶色尿和食慾不振[1]。疾病的早期通常沒有症狀,且這些症狀通常不具特異性,因此發現胰臟癌時常常已經進展到癌症晚期[1][2],癌細胞已經遠端轉移到身體其他部位[6][11]。
胰臟癌很少發生在40歲以下的病人,半數以上的患者超過70歲[2]。胰臟癌的風險因子包括吸菸、肥胖、糖尿病和特定的罕見基因[2]。 約20%的胰臟癌和抽菸有關[3], 5–10%則和遺傳因素有關[2]。胰臟癌的診斷常結合醫學影像(超音波和電腦斷層)、血液檢驗和組織切片等技術[3][4]。癌症分期則分為最早的第I期到最嚴重的第IV期[11]。目前尚無合適的方法能針對群眾篩檢胰臟癌。[12]
非吸煙者和少吃紅肉或加工肉品的人罹患胰臟癌的風險較低[5]。吸菸者在戒菸後罹癌的機率會降低,戒菸20年後風險甚至能降到與一般人無異[6]。胰臟癌的治療方法有手術、放療、化療、和缓医疗或結合上述數種療法[1],療法的選擇和癌症的分期有關[1]。手術是唯一能治癒胰臟腺癌的方法[11],針對無法治癒的患者,手術則以提升生活品質為目標[1][11]。患者有時也會需要控制疼痛和促進消化的藥物[11],即便是接受積極治療的病人,也建議在疾病早期就實施緩和療護。[13][14]
2015年,胰臟癌在全球已造成約411,600人死亡[9],為英國第五大死因[15],美國第四大死因[16][17]。胰臟癌於已開發國家較常見,佔了2012年新病例的70%[6]。胰臟腺癌的預後通常很差,一年存活率和五年存活率分別僅有25%和5%[6][7];早期診斷的五年存活率則提高到約20%[18]。神經內分泌腫瘤的預後則較好,診斷後的五年存活率約有65%,雖然患者預後仍需視個別癌症種類而定[6]。
 播放媒体
播放媒体解說影片(英文)
目录
1 種類
1.1 外分泌腫瘤
1.2 神經內分泌腫瘤
2 症狀及徵象
2.1 其他表徵
2.2 遠端轉移後的症狀
3 風險因子
3.1 遺傳性
3.2 酒精
3.3 其他
4 診斷
5 分期
5.1 外分泌腫瘤
5.2 神經內分泌腫瘤
6 癌前病變
6.1 外分泌腫瘤
6.2 神經內分泌腫瘤
7 預防和篩檢
8 處置
8.1 外分泌腫瘤
8.1.1 手術
8.1.2 化療
8.1.3 放射線療法
8.2 神經內分泌腫瘤
8.3 安寧療護
9 預後
10 流行病學
10.1 神經內分泌腫瘤
11 歷史
12 研究方向
13 去世名人
13.1 东方
13.2 西方
14 參見
15 注释
16 參考文獻
17 外部連結
種類

胰臟的胰岛和外分泌腺體具有許多功能,胰臟癌能夠從其中的任何一種細胞產生,並干擾相關功能。
胰臟癌雖然有許多種,但可粗略歸為兩大類。絕大多數(約99%)的胰臟癌發生在胰臟的外分泌部(分泌消化酶的地方),此處的各種癌症在診斷和治療上都有許多的共通點;另一些癌症則發生在胰臟的內分泌部(分泌激素的內分泌組織),特色和前者截然不同。這兩類的胰臟癌都好發(但並非絕對)於40歲以上的患者,且男性稍多於女性,但少數亞型在女性和孩童身上較常見[19][20]。
外分泌腫瘤
最常見的外分泌胰臟癌為胰臟腺癌(pancreatic adenocarcinoma)[註 1],佔所有胰臟癌的約85%,約60%到70%的胰臟腺癌發生於胰頭部[27]。
胰管是將胰臟外分泌腺的分泌物(例如酶以及碳酸氢盐)運輸出胰臟的組織,儘管構成胰管的上皮細胞只佔胰臟細胞總體積的10%[28],多數的胰臟腺癌始於胰管,稱為胰臟管腺癌(pancreatic ductal adenocarcinoma,PDAC)[29]。
第二常見的胰臟癌為發源於胰臟外分泌腺體細胞的胰臟腺泡細胞癌,佔胰臟外分泌癌症的5%,腺泡細胞會過度分泌特定的分子消化酶而導致如皮膚紅疹和關節痛等症狀[30]。
囊腺癌佔了胰臟癌1%的病例,預後較其他外分泌胰臟癌佳[30]。胰母细胞瘤則是一種較少見的癌症,幾乎都發生在孩童,且有相對較好的預後。其他胰臟癌的種類還包括腺鱗狀細胞癌、印戒细胞癌、肝樣細胞癌、膠狀癌、未分化腺癌和具有蝕骨細胞樣巨大細胞的未分化腺癌。固狀偽乳頭狀腫瘤是一種罕見但低度惡性的腫瘤,主要發生在年輕女性,預後良好[2][31]。
胰黏液性囊性腫瘤包含多種胰臟腫瘤,且惡性程度不一。隨著電腦斷層技術的進步和普及,此類腫瘤的檢出率也越來越高。此類腫瘤大多為良性,目前治療及評估方法仍持續討論中[32]。
神經內分泌腫瘤
少數的胰臟癌由其他非外分泌的細胞造成,其中絕大部分為胰臟神經內分泌腫瘤(PanNET)[33]。神經內分泌腫瘤是一類多樣的良性或惡性腫瘤,源自於協調神經與內分泌系統的神经分泌细胞。這類腫瘤能在體內多數的器官內產生(包括胰臟),但惡性的類別十分罕見。PanNETs可依其製造激素的能力分為「功能性」和「非功能性」兩類,功能性腫瘤能將胰岛素、胃泌素或升糖素等激素分泌到血液中,過多的激素可能會產生對應的症狀(例如過多的胰島素造成低血糖),因此也較容易早期發現。多數的功能性PanNET為胰島素瘤和胃泌素瘤,腫瘤依其分泌的激素種類命名。非功能性的PanNETs可能不分泌激素或分泌的量不足以造成明顯的症狀,因此此類腫瘤常在擴散到身體其他地方後才被診斷出來[34]。
如同其他部位的神經內分泌腫瘤,PanNETs的分類和命名歷史相當複雜[33],它有時又被稱為胰島癌[35],雖然目前已知這些癌細胞並非都源自胰島細胞[34]。
症狀及徵象

胰臟癌會導致膽管阻塞,進而導致黃疸。
胰臟癌初期通常沒有明顯的症狀,因此通常都是在轉移後才發現[4],這也是胰臟癌一般預後極差的原因之一。但胰臟神經內分泌細胞瘤(PanNETs)除外,此類腫瘤可能會分泌過多的激素而造成對應的症狀(症狀類型需視其分泌的激素種類而定)[36]。
胰臟癌多半發生在40歲以上的人,在胰臟腺癌被診斷出來之前常會發生以下症狀:
上腹痛或背痛:通常發生在胃的周圍以及此處往背部延伸的部位。疼痛的位置和腫瘤的位置相關,患者可能晚上睡覺時較痛,疼痛隨時間增加而不會緩解[30],將身體前傾能稍微紓解症狀。英國有一半的胰臟癌病例是患者因疼痛和黃疸前往急診室而被診斷出來的,其中多達2/3的患者以腹痛為主訴,46%的患者伴隨黃疸,而13%的患者有黃疸但無腹痛[11]。- 疼痛或無痛性的黄疸(皮膚或眼白變黃):當腫瘤位於胰臟的頭部而造成總膽管阻塞時便會發生,有時也可能伴隨黑尿。[37]
不明原因的體重減輕:這可能是食慾不佳或外分泌腺體失能而導致消化不良的結果。[11]
- 消化道症狀:腫瘤也可能壓迫周圍的器官,阻礙消化道並造成胃排空困難,進而引發噁心、嘔吐、飽足感等症狀。未消化的脂肪會導致惡臭且沖水沖不掉的脂肪便[11],便秘也是常見的臨床表現[38]。
- 糖尿病:至少一半的胰臟腺癌患者在被診斷出來的當下患有糖尿病[2]。雖然已知長期糖尿病是胰臟癌的風險因子,但胰臟癌本身也可能造成糖尿病,因此近期才發作的糖尿病也有可能是癌症的早期表現[39]。50歲以上的糖尿病患者三年內罹患胰臟腺癌的機率是常人的8倍,但三年後患上癌症的機率則逐漸降低[11]。
其他表徵
遊走性血栓靜脈炎:門脈、四肢深層靜脈或身體各處表淺靜脈的血栓生成可能也和胰臟癌有關,10%的患者有此現象[3]。
重性抑郁障碍:10–20%的胰臟癌患者會變得憂鬱並排斥治療,此現象也可能在診斷出癌症前就發生,代表憂鬱可能是癌症本身透過生理機制造成的[3]。
其他常見的表徵還包括:虛弱、疲勞、口乾、睡眠問題、可觸摸的腹部腫塊等[38]。
遠端轉移後的症狀

人類肝臟解剖,可看到許多白色的來自胰臟癌的轉移腫瘤。
胰臟癌的遠端轉移也可能造成症狀。典型的胰臟腺癌會先散播到鄰近的淋巴結,接著再擴散到肝臟、腹膜腔、大肠或肺臟等處[3],轉移到骨頭或大腦的狀況則不常見[40]。
胰臟內的腫瘤也可能來自身體的其他地方,但這種狀況很少見,僅佔所有胰臟腫瘤的2%,其中又以腎臟癌最多,其次是大腸癌、黑色素瘤、乳癌和肺癌。一般可以用手術來移除這些腫瘤以治療或減輕症狀[41]。
風險因子
已知的胰臟癌風險因子包括[6][2][11][42]:
- 年齡、性別、族裔:罹患胰臟癌的風險隨著年齡增加,多屬的患者超過65歲[6],小於40的患者較少見。胰臟癌在男性的發生率略高於女性。美國的統計指出非裔美国人的發生率較平均高出1.5倍,但胰臟癌在非洲的發生率並不高[6]。
吸菸:為目前研究最為透徹且可以避免的胰臟癌風險因子,長期吸菸罹患胰臟癌的風險大約會增為2倍,且風險隨菸齡增加。戒烟後風險會緩慢下降,大約20年後才能回復到與非吸菸者無異[43]。
肥胖:BMI 大於35的人風險約為一般人的1.5倍[11]。
遺傳性
5–10%的胰臟癌患者家族成員也有該病病史[2][44]。若多於一位一等親罹患該疾病,患病機率會大幅增加,且常在50歲之前發病[4]。遺傳性胰臟癌會提升70歲以前的發病風險約30–40%[3]。大多數與胰臟癌相關的基因目前仍屬未知[2][45]。針對高遺傳風險的患者,可以進行早期篩檢,但由於目前已知的因子不足,篩檢無法完全防範[46]。有些人甚至會選擇預防性切除胰臟[3]。
胰臟癌與許多疾病相關,包含[2][3][4]:
珀茨-杰格斯综合征:與STK11肿瘤抑制基因相關。此疾病相當罕見,但為強風險因子。
發育不良母斑症候群:又稱家族性非典型多痣黑素瘤(familial atypical multiple mole and melanoma syndrome,FAMMM-PC),與CDKN2A抑癌基因相關。
共濟失調微血管擴張症候群:與體染色體隱性的ATM基因,以及體染色體顯性的BRCA2和PALB2基因相關。- 遺傳性非瘜肉症結直腸癌
- 家族性結直腸瘜肉綜合症
多發性內分泌腫瘤第一型(MEN1)及希佩尔-林道综合征:與胰腺神經內分泌腫瘤相關。
酒精
酗酒是造成慢性胰臟炎的主要原因,慢性胰臟炎患者也比較容易得到胰臟癌。然而,諸多研究卻都無法證實酒精飲用量是罹患胰臟癌的直接風險因子。整體而言,這兩者的關聯性很低,多數的研究甚至得到兩者沒有關聯的結論,但在統計分析中,吸菸是個很強的干擾因子。大量飲酒則和胰臟癌有比較強的關聯[47][48]。
其他
慢性胰臟炎患者罹患胰臟癌的風險為正常人的3倍,另外,胰臟癌的症狀也可能會以新發病的糖尿病或胰臟炎表現[49]。罹患遺傳性胰臟炎的人罹患胰臟癌的風險較高[49][50]。
糖尿病是胰臟癌相當重要的風險因子,新發病的糖尿病患者也可能會有上述的各種徵象。被診斷為2型糖尿病達10年以上的患者比非糖尿病患者多出了50%的風險[49]。- 目前還沒有確認特定的食物會增加胰臟癌的風險(和肥胖不同)[2],但有些跡象顯示加工肉品、紅肉和高溫烹煮的肉類(如炒、烘烤、炙烤)可能會些微增加風險[51][52]。
診斷
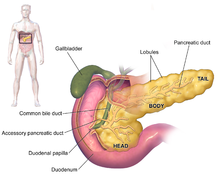
胰臟的頭部、體部,以及尾部。在圖中為顯示胰臟的全貌,將胃的顏色刷淡,以顯示胰臟的尾部、體部,及一部分頸部位於胃後方。

靜脈注射顯影劑的斷層掃描圖,十字中心的區域為被黏液性囊腺癌圍住的胰臟頭。
胰臟腺癌在初期不會有任何特殊症狀,目前也沒有較好的鑑別診斷方式[11][3][37],其症狀隨腫瘤的位置不同而異。
不論腫瘤具体位置,胰臟癌最常見的症狀為不明原因的體重減輕。35-47%的人有噁心、嘔吐和虛弱感。胰頭的腫瘤還可能導致黃疸、疼痛、食慾不振、茶色尿及淺色糞色。胰體及胰尾的腫瘤則可能導致疼痛[37]。
胰臟癌發病時,患者可能同時伴有最近發生且難以控制的非典型2型糖尿病,或病因不明的血栓靜脈炎(即特羅索氏徵),患者也可能有胰臟炎病史[37]。超過五十歲的糖尿病患者伴有不明原因的體重減輕、持續腹痛或背痛、消化不良、嘔吐以及脂肪便等典型症狀時,醫師便會懷疑患者有胰臟癌[11]。黃疸伴隨無痛的膽囊腫脹(即庫爾瓦澤爾茲氏徵)也進一步增加了胰臟癌的可能,並能幫助胰臟癌與膽結石的鑑別診斷[53]。
胰臟癌可借助電腦斷層(CT)或內視鏡超音波(EUS)等醫學影像技術確診,並協助判斷腫瘤是否能以外科手術切除[11]。在配合顯影劑使用的電腦斷層掃描中,胰臟癌會慢慢的吸收顯影劑,而正常的胰臟組織則會將顯影劑快速排除,慢性胰臟炎排除顯影劑的速度則較慢[54]。核磁共振和正子電腦斷層掃描也可用來診斷胰臟癌[2];在某些案例中,核磁共振膽胰管攝影術也很有用[37]。 腹部超音波的敏感度較低,可能會遺漏較小的腫瘤,但能協助診斷散播到肝臟或腹水中的腫瘤[11];由於腹部超音波便宜又快速,在做其他檢查前也能以此做初步的檢查[55]。
若診斷尚有不明之處,則可以內視鏡超音波術輔助細針抽取細胞檢查做病理診斷;但對於勢必要切除腫瘤的病患則不一定需進行細針病理切片[11]。
肝功能測試為膽道鬱積的指標(包括共軛膽紅素、γ-GT、碱性磷酸酶增加)。CA19-9為胰臟癌患者體內常提升的一種腫瘤標記;但有5%的人缺乏路易士抗原系統,因此無法製造該蛋白。CA19-9診斷胰臟腺癌的靈敏度約80%,特異度約73%,靈敏度和特異度皆不夠高;比起用於診斷,該標記更適合用來追蹤已確診病人的病況[2][11]。
最常見的胰臟癌為胰臟腺癌,顯微鏡鏡檢下以中度到低度分化的腺體結構為特色,通常伴有大量的結締組織增生,也可能有緻密纖維基質(如第一型膠原蛋白和透明质酸沉積)與細胞(包括肌纖維母細胞、巨噬细胞、淋巴细胞、肥大细胞)產生。這些組織變化創造了缺乏血管和氧氣的腫瘤微環境[2],造成許多化療藥物無法到達腫瘤所在,使得此類癌症難以治療[2][3]。
分期
外分泌腫瘤
胰臟癌的分期通常必須借助電腦斷層[37],最常使用的分期系統是美國癌症聯合委員會(AJCC)與國際抗癌聯盟(UICC)共同制定的系統。AJCC-UICC分期系統將胰臟癌根據TNM系統分為四期,「T」代表腫瘤的大小,「N」代表淋巴結擴散程度,「M」則代表遠端轉移[56]。
為了輔助判斷後續治療,腫瘤也可根據是否可以手術切除來分為「可切除」(resectable)、「臨界可切除」(borderline resectable),以及「無法切除」(unresectable)等三大類[57]。如果腫瘤仍為初期(AJCC-UICC第一期或第二期),尚未擴散到血管或遠端器官,則建議最好進行手術切除[11]。AJCC-UICC分期系統的第三期包括了「臨界可切除」(borderline resectable,指腹腔動脈和上腸繫膜動脈仍未被波及而能動手術者)和「不可切除」(局部侵犯更嚴重的)的胰臟癌;對應到詳細的TNM分級的話,這兩者分別為T3和T4[3]。
- 胰臟癌分期(TMN分期系統)

胰臟癌T1期

胰臟癌T2期

胰臟癌T3期

胰臟癌T4期

鄰近淋巴結的胰臟癌,N1期

胰臟癌遠端轉移(M1期)
局部侵犯較嚴重的腫瘤可能會波及以下鄰近器官(粗略按照發生率遞減排序):十二指肠、胃、横结肠、脾脏、腎上腺和腎。腫瘤也很常散播到胰臟周圍重要的血管、淋巴管或神經,讓手術變得困難許多。第四期癌症典型的遠端轉移位置有肝臟、腹膜腔和肺,50%以上的轉移位置都在這三個器官[58]。
神經內分泌腫瘤
2010年WHO消化系統腫瘤分類將所有胰臟神經內分泌腫瘤(PanNETs)依據其細胞分化程度分為三級,包括從分化程度最好的NET G1到分化很差的NET G3[20]。美國國家綜合癌症網絡則建議對神經內分泌腫瘤採用和胰臟腺癌相同的AJCC-UICC分期系統[59]:52,然而在這個系統下,PanNETs和相同分期的外分泌腫瘤預後並不相同[60]。此外,歐洲神經內分泌腫瘤協會另有提出一種不同的TNM分類系統[20]。
癌前病變

胰臟管腺癌(最常見的胰臟癌)的顯微照片,H&E染色。
外分泌腫瘤

正常胰臟(Normal)、胰臟上皮瘤病變(PanIN,為胰臟腺癌的癌前病變)與胰臟腺癌(右圖)的顯微照片,H&E染色。
此類腫瘤一般認為源自於數種胰內的癌前病變,但這些病灶未必一定會演變為癌症。隨著電腦斷層的普及及進步,有越來越多的上述病灶被偵測出來,此類病灶未必需要治療[3],這些病灶中最常見的為胰漿液性囊腺瘤,此類幾乎都為良性,除此之外還有另外三種病理狀態:
第一種為胰臟上皮瘤病變,屬於組織病變。這類病變通常發現於生前無癌症報告的法醫學診斷。此類病灶擁有分級系統,惡性度最高者即為惡性腫瘤。90%以上病例擁有KRAS基因突變,2至3級則可能額外還有CDKN2A (p16)、p53 、SMAD4等基因的突變[2]。
第二種為胰管內乳頭狀黏液性腫瘤(IPMN),成人盛行率約2%,到70歲時則提升到約10%,而其中25%有成為惡性腫瘤的風險。這些腫瘤常有KRAS基因突變(40-65%)和影響Wnt訊息傳遞路徑的GNAS與RNF43突變[2]。即使在手術切除腫瘤後,患者之後罹患胰臟癌的機率仍然比常人高出許多[3]。
最後一種則是主要發生在女性的胰黏液性囊狀腫瘤(MCNs),它可能維持良性或發展為惡性[61]。如果腫瘤變大、造成異常症狀或有任何可疑的特徵,醫師通常能藉由手術將腫瘤完整切除[3]。
胰管腺癌的基因變化已經被詳細研究,較常見的癌症類型也已經有完整的外顯子體定序。胰臟腺癌有四種主要的基因突變:KRAS(95%)、CDKN2A(95%)、TP53(75%)和SMAD4(55%),其中擁有SMAD4突變的腫瘤預後較差[3]。SWI/SNF突變或缺失也出現在10–15%的胰臟腺癌案例中[2]。其他一些類型的胰臟癌和胰臟癌前病變的基因變化也已有研究發表[3]。
神經內分泌腫瘤
胰臟神經內分泌腫瘤(PanNETs)常見的突變基因和胰臟腺癌不同[62]。例如PanNETs通常沒有KRAS突變,但卻常有遺傳性的MEN1基因突變,造成MEN1症候群(一種常造成多種原發性內分泌腫瘤的遺傳性疾病),帶有MEN1突變基因的人大約40-70%會罹患PanNet[63]。其他常見的基因突變包括DAXX、mTOR和ATRX[34]。
預防和篩檢
除了不要抽菸之外,美国癌症协会也建議人們維持健康的體重、增加蔬果和全穀的攝取,同時減少食用加工肉品,雖然目前沒有明確的證據顯示這能有效預防並降低罹患胰臟癌的機率[64]。一份2014年文獻回顧總結了先前的研究,指出增加柑橘和薑黃的攝取能減少胰臟癌的風險,而全榖、葉酸、硒和非油炸的魚肉可能也有幫助[65]。
目前仍沒有適合對群眾篩檢的方法,新的技術和針對特定族群的篩檢方法還正在研究評估[66][67]。然而,對高遺傳風險的族群而言,使用內視鏡超音波和MRI/CT造影是目前建議的例行性篩檢方式[4][55][67][68]。
處置
外分泌腫瘤
腫瘤是否能以手術切除是胰臟癌確診後重要的評估項目,因為手術切除是目前唯一治癒該病的方法。而腫瘤能否切除則取決於它侵犯和擴散的程度,腫瘤本身的位置也是個重要的因子,CT能顯示出病灶與胰臟附近血管的相對位置。病患自身的健康狀況也需被評估,雖然年齡本身並不是手術能否進行的決定性因素[3]。
無論是否能進行手術,多數的患者會接受化療和放療(後者較少)。胰臟癌的處置需要跨領域團隊合作進行,包括腫瘤科等專家,因此在大型醫學中心處置會是最好的選擇[2][3]。
手術

藍色區塊為胰十二指腸切除術的範圍。(圖中肝為紫色,胃為橘色,胰為黃色)
大約只有20%的胰臟癌有手術治癒的機會[11],雖然CT很有幫助,但要判斷腫瘤是否能完整移除仍然十分困難,很可能手術進行時才發現腫瘤無法在不破壞其他維生器官的情形下完整移除。決定是否進行手術受到許多因素影響,包括腫瘤確切的解剖位置是否靠近或侵犯到靜脈或動脈[2] 、外科技術以及術後復原的考量等[69][70]。患者的年紀本身並非決定手術與否的條件,但其綜合日常體能狀態必須足以支應大手術帶來的衝擊[11]。
腫瘤和周圍的血管之間是否有明顯的脂肪作為分界是手術評估的一項重要指標,若腫瘤與血管有明顯區隔者較適合進行手術[3],傳統上會測量腫瘤到鄰近主要動脈或靜脈的最短距離,並以相鄰(abutment,指腫瘤與血管的距離不足該血管圓周的一半且無脂肪分隔兩者)、包圍(encasement,指腫瘤包圍大部分的血管壁)或全血管侵犯(full vessel involvement)來描述腫瘤與血管之間的關聯[71]:22。包圍血管的腫瘤在一些情形下是可行的[72][73],特別是能使用前導性化學治療[74][75][76]、化療[70][71]:36[77]或放療[71]:29–30的時候。
即使手術表面看來成功,腫瘤邊緣剩下組織的病理切片卻常會發現癌症細胞,這意味著癌症細胞並未完全被移除[2];更糟的是,癌幹細胞在顯微鏡下並不是很明顯,它們可能繼續發展為癌細胞並往外擴散[78][79]。因此,術後可用腹腔鏡檢查(一種小型、影像導引的手術)更進一步地了解手術後的整體成效[80]。

胰十二指腸切除術後胰臟和腸道的連接方式。
針對涉及胰頭的癌症,最常使用的手術方法是胰十二指腸切除術,這是個將胰頭連同十二指腸一起切除的大手術,術中切除十二指腸後會將胃和空腸相接,並留一段空腸的盲端來導引膽汁。這項手術只有在病人身體足以承擔大型手術,且癌症並未局部擴散或轉移時才會採用,因此只有很少數的病例進行胰十二指腸切除術。 胰尾的腫瘤則能用遠端胰切除術移除,手術中也常會將脾臟一併切除[2][3]。現在這些術式常能以微創手術完成[2][3]。
雖然在1980年代以後,以治癒為目標的手術不再意味著高死亡率,但仍有許多患者(約30至45%)必須接受術後治療,以處理非癌症本身導致的術後併發症,其中最常見的併發症為胃排空障礙[3]。一些較局部的手術也能用來減輕症狀,但就不是以治癒癌症為目標,例如在侵犯十二指腸或大肠的案例中便能藉由繞道手術來維持患者消化道的暢通,藉以增進患者的生活品質,但無法根治癌症[11]。
化療
若病人的情況許可,可在手術後一段時間給予吉西他滨或5-FU等藥物進行輔助性化療,通常輔助性化療會在術後一至兩個月實施[4][55]。對於身體情況不允許進行治癒性手術的病患,化療或許可以延長其生命或提升生活品質[3]。臨界可切除(參見分期一節)的病患,可在術前進行前導性化療或化放療可能可以使腫瘤縮小至可以切除的程度。除上述情形以外,進行前導性化療與否仍有爭議,但可以延遲手術的進行[3][4][81]。
吉西他滨在臨床試驗證明可以改善生活品質,並可延長存活中位年數長達五周後,於1997年獲美国食品药品监督管理局(FDA)核可使用於胰臟癌[82]。在本品的臨床試驗之前,藥物的效果基本上僅以存活率評估。吉西他滨是FDA首支以臨床效益(clinical benefit)核可的藥物[83]。此後長達十年的時間胰臟癌化療的標準療程都只單用吉西他滨,其他藥物組合試驗都沒有更顯著的效果。直到後來吉西他滨與厄洛替尼可以稍微提升存活率,厄洛替尼也於2005年核准用於胰臟癌的化療[84]。
FOLFIRINOX化療處方利用了四種藥物,比單獨使用吉西他滨更有效,但具有嚴重的副作用,因此僅適用於體能狀態較佳者。副作用同樣較強較強的還有蛋白結合性紫杉醇(nab-paclitaxel),該藥與吉西他滨並用治療胰臟癌的療法於2013獲FDA核可[85]。截至2013年底,對於體能狀況較佳者,上述兩種療法是較佳的選擇。而對於體能狀況不許可者,則可單獨使用吉西他滨。兩種療法的平行對照研究仍在進行當中,並有許多其他療法的研究也在持續進行中。但前幾年的研究都僅能較原療法延長數個月壽命[82]。有多項臨床試驗研究經典輔助性療法的效果[4]。
放射線療法
手術後進行輔助性放療的效果至今仍未有共識[3]。歐洲腫瘤學學會建議僅對註冊進行臨床試驗者進行放療[55],美國則相較歐洲來說對放療持更積極的態度。自1980年代起,學界便進行許多臨床試驗,但迄今仍未獲得明確結果[3][4]。
放療也許又助於將腫瘤縮小至可切除的大小。但對於不可切除的腫瘤而言,研究的結果仍有歧異。2013年一項研究的初步結果顯示放療可降低局部晚期腫瘤的活躍程度[2]。
神經內分泌腫瘤
胰臟神經內分泌腫瘤(PanNETs)的有多種治療方式,此類的惡性腫瘤較為罕見[59][86][87][88]。一些偶然發現的小型腫瘤(小於1公分),例如因為其他目的而做電腦斷層掃描時發現者,可能會先採取觀察性等待的消極策略[59]。採用何種策略取決於手術的風險評估以及患者產生其他共病的機率[59],例如侷限於胰臟內或僅小範圍轉移的腫瘤可能就會以手術切除,手術的方式則端看腫瘤的位置和淋巴結擴散的程度[20]。
相較於胰臟腺癌,局部的神經內分泌腫瘤切除手術需要切除的範圍小很多,除此之外手術的方式皆與外分泌腫瘤相同。術後的預後差異很大,有些類型的存活率很高,有些死亡率則較高。由於無論是哪種類型的神經內分泌腫瘤都很少見,醫療指引強調這類病患需在專門的醫學中心診治[20][34]。若腫瘤有肝臟轉移,肝臟移植也是可以考慮的選項[89]。
功能性腫瘤(即會分泌激素的腫瘤)可以使用體抑素類似物等藥物(如奥曲肽)來減少激素的產生[20],兰瑞肽(lanreotide)則能減緩腫瘤的生長[90] 。如果腫瘤不適合以手術移除但卻造成不適的症狀,以癌伏妥或舒尼替尼等藥物進行標靶治療或許能減緩症狀和病程[34][91][92]。標準的胞毒性化療一般而言對PanNETs沒有用,但當其他藥物治療失敗時也可用來試著減緩病程[34][93],有時也用在分化不佳的PanNETs[94]。
若腫瘤持續向外擴張(例如轉移到骨頭),有時也會考慮使用放射療法。此外,一些PanNETs會吸收特定的多肽或激素, 因此能採用核子醫學療法,以帶放射性的多肽或激素治療(例如碘苄胍,即碘-131-MIBG)[95][96][97][98]。射頻燒灼術(RFA)、冷凍消融術和肝動脈栓塞也是可以考慮的治療方式[99][100]。
安寧療護
安寧療護著重於疾病的症狀治療,目的在減輕病患的痛楚、增進患者生活品質[101] 。由於胰臟腺癌常到後期才被診斷出來而難以治癒,在這種情況下,安寧療護成了唯一可行的治療方式[102]。安寧療護並不以根治疾病的源頭為目標,而是要緩解如疼痛或噁心等症狀,並協助患者對決定往後的療程與規劃,包括是否住進安寧病房等重大醫療決策[103],疼痛的常見處置方式則有使用鴉片類藥物或進行手術。
腔神經叢阻斷術(CPB)截斷了負責傳遞腹部疼痛的神經,因此能舒緩腹部疼痛的感覺,這是一種安全且有效的方式,患者在術後能減少鴉片類藥物的使用量,進而避免藥物相關的副作用[3][104]。另一種能藉由手術緩解的症狀為腫瘤導致的腸道或膽管阻塞,超過一半的膽管阻塞患者能以內視鏡手術置入金屬支架,維持膽管的暢通[37]。安寧療護也幫助解決被診斷出癌症後伴隨而來的憂鬱症[3]。
胰切除術或無法手術的大腫瘤常因為胰臟的外分泌功能不足而導致消化系统問題,這樣的症狀可以服用人工生產的胰脂肪酶來解決,此類酵素配飯吃效果最好[11]。胃排空障礙也是很常見的問題,症狀有時會嚴重到必須住院,胃排空障礙的治療方式有很多,包括鼻胃管引流、服用氫離子幫浦阻斷劑或組氨酸H2受體拮抗劑,後兩種藥物能夠減少胃酸分泌[11]。甲氧氯普胺等促進消化道運動的藥物也能用於協助胃排空[105]。
預後
| 臨床分期 | 五年存活率(%):美國,1992–98年 | |
|---|---|---|
| 外分泌性胰臟癌 | 接受手術後的神經內分泌腫瘤 | |
| IA / I | 14 | 61 |
| IB | 12 | |
| IIA / II | 7 | 52 |
| IIB | 5 | |
| III | 3 | 41 |
| IV | 1 | 16 |
由於胰臟腺癌和其他較少見的外分泌腫瘤多半都到末期才被發現,腫瘤已經嚴重的侵犯周圍組織或轉移,因此預後通常很差[2]。胰臟神經內分泌腫瘤的預後則樂觀許多,其中有很多個案是良性且沒有任何臨床症狀的,即使是無法以手術治療的患者五年存活率平均也有16%[57],其預後很大部分取決於神經內分泌腫瘤的類型[36]。
局部侵犯較嚴重或已轉移的胰臟腺癌佔了超過80%的病例,針對這些患者,許多比較化療配方的臨床試驗顯示這些藥物能延長存活時間,但不超過一年[2][82]。美國的胰臟癌五年存活率已經從1975到1977年的2%進步到2003到2009年間的6%[106]。僅有20%的患者在胰臟腺癌還很小且侷限於病灶處時被診斷出來(小於2公分,處於T1期),針對這些患者,美國的五年存活率為20%[18]。
流行病學

胰臟癌在各國的死亡率(2012年,每百萬人)。 .mw-parser-output .refbegin{font-size:90%;margin-bottom:0.5em}.mw-parser-output .refbegin-hanging-indents>ul{list-style-type:none;margin-left:0}.mw-parser-output .refbegin-hanging-indents>ul>li,.mw-parser-output .refbegin-hanging-indents>dl>dd{margin-left:0;padding-left:3.2em;text-indent:-3.2em;list-style:none}.mw-parser-output .refbegin-100{font-size:100%}
0–4
5–6
7–9
10–15
16–25
26–33
34–70
71–121
122–162
163–235
截至2012年,胰臟癌在全球已造成約330,000人死亡[6]。比2010年多出了20,000人[107]。光是在2016年的美國,就有53,070人新檢出胰臟癌,41,780人因此而死亡[108]。雖然胰臟癌只佔新檢出病例的3.1%,但卻占了該年死亡率的7%[108]。
胰臟癌為造成全球癌症死亡人數第七高的疾病[6]。在女性為常見癌症的第11名,男性則為第12名[6]。多數案例發生於已開發國家[6]。美國人胰臟癌的平均累积发病率約為每67人中一位(約1.5%) [109],較英國稍高[110]。其中男性病患較女性為多[6][2],但近年內,兩性之間的差異在逐漸縮小,可能與過去女性抽菸率的上升有關。在族裔部分,非裔美国人的發生率較白人高出了50%,但非洲與東亞的發生率則遠低於北美及歐洲。美國、中歐、東歐、阿根廷,及烏拉圭的發生率較高[6]。
胰臟癌為英國第十大死因(2011年約有8,800名新病例),並為致死人數第五高的癌症(2012年約有8,700死亡)[111]。
神經內分泌腫瘤
根據臨床診斷,胰臟神經內分泌腫瘤(PanNETs)的年發生率並不高(每年每百萬人中約5人),且大多數為非功能性型[31],約佔PanNET的45%至90%[20][34]。然而遺體解剖則發現小型的PanNETs比例其實相當高,代表有高比例的腫瘤是無症狀的[34]。PanNET約佔所有胰臟癌的1-2%[31]。此類疾病的定義時常變動,使其流行病學和臨床相關性的知識常常受到影響[62]。
歷史
1761年,有「現代解剖病理學之父」之稱的義大利科學家乔瓦尼·莫尔加尼,在其論文〈五具遺體的病理解剖報告〉('De Sedibus Et Causis Morborum Per Anatomen Indagatis Libri Quinque.')中首次提及胰臟癌[112]。但由於缺乏顯微鏡的證據,無從判斷這份報告的結論是否正確。且由於胰臟癌在巨觀下與胰臟炎相當類似,當時許多醫師質疑原發於胰臟的癌症是否存在[113]。直到1858年,美國的雅各布·曼德斯·達·哥斯達醫師發表了首篇附上顯微鏡檢結果的胰臟腺癌診斷,才正式證實了胰臟腺癌的存在[112]。至20世紀初,發生於胰臟頭的癌症已經有相對成熟的診斷方法[113]。
胰臟的神經內分泌腫瘤(PanNETs)則直到1888年才首次提及,首例因PanNETs造成的胰島素過高病例報告於1927年發表。1955年,美國外科醫師R·M·索林格(R. M. Zollinger)和E·H·艾利森(E. H. Ellison)於兩例異常嚴重胃潰瘍的病例報告中,推測胰臟分泌胃泌素細胞發生腫瘤的可能性,此後這種疾病也依兩人的名字命名為索林格-艾利森氏症候群,一般文獻認為這是首次發現非胰島素性的PanNETs[113]。2010年,世界衛生組織建議將PanNETs從「內分泌腫瘤」歸入「神經內分泌腫瘤」之列[33]。
1898年,義大利外科醫師亞歷山德羅·科迪維利亞執行首例胰十二指腸切除術,但後來患者在18天後即因併發症去世。早期醫師誤以為十二指腸為人類存活之必須,因此完全不考慮切除。同時胰液的引流也是當時爭論不休的話題,一開始有人認為胰液的流向是生存的關鍵,但隨即有人發現胰液於何處進入腸道與存活無關。然而,這卻造成某些醫師誤以為將胰管完全結紮不會有任何副作用,但事實上這麼做會導致瘻管的產生,使胰液滲入腹腔。1907–08年間,在經過多例不成功的手數後,法國外科醫師開始在屍體上進行模擬手術,研究手術流程[114]。
1912年,德國外科醫師瓦尔特·考施於波蘭弗罗茨瓦夫的布雷斯勞,進行首次同時移除胰臟及大部分十二指腸的手術。1918年,有人證實將狗的十二指腸切除,犬隻仍能繼續存活,但直到1935年,美國醫師艾倫·惠普才首次在人類身上切除十二指腸。當時惠普於紐約市的哥倫比亞長老教會醫院進行三例手術,其中一名分兩階段完全切除十二指腸,並且存活了兩年後才死於肝轉移。這次手術完全是出自偶然,因為腫瘤是在手術室內才發現。惠普的成功為胰臟癌手術的發展奠定了重要的基礎,但時到今日,胰十二指腸切除術仍是相當具有挑戰性,且風險極高的手術。惠普並於1940年進行首例一階段性十二指腸全切除術,此後也持續改良其術式,一生共進行了37次胰十二指腸切除術[114]。
1930年代末期發現维生素K能預防出血,同時輸血技術也大幅進步與普及,使得術後存活率大幅增加[114],但直到1970年代以前,25%的患者在術後始終無法活著離開醫院[115]。1970年代,一個美國的外科團隊甚至力勸醫界廢除此種手術,因為它實在是太過危險。但也是從同時期開始,大型醫學中心胰臟癌手術的預後大幅好轉,手術死亡率逐漸降到4%以下[116]。一份2006的研究發表了约翰·霍普金斯医院一位外科醫師的手術報告,該醫師在1969和2003年間執行了1000例胰十二指腸切除術,其中1980年以前只有3例,在此段期間內的手術存活率穩定上升,手術時間的中位數也從1970年代的8.8小時縮短到2000年代的5.5小時,30天內或住院期間的死亡率則僅有1%[114][115]。另一系列由麻省總醫院在1941和2011年間執行的2050例手術也呈現類似的變化趨勢[117]。
利用現代醫學影像技術,發現胰臟腫瘤癌前病變的比例逐漸提高,例如日本研究者在1982年首次發表了胰管內乳頭狀黏液性腫瘤(IPMN)。2010年的一份文獻稱「未來十年可能不會有人注意到這份文獻,但接下來的15年,對胰臟癌的認識會有爆炸性的成長。」[58]
研究方向
目前世界各國對於胰臟癌的研究正如火如荼地進行,然而進展仍然不大,尤其是胰臟腺癌的誘發原因迄今不明[118][119][120]。科學家正致力於釐清胰臟腺癌的致病機轉,例如KRAS和p53等基因在該疾病中所扮演的角色[45][121][122]。另一項最關鍵的研究重點之一是病程的進展,特別是糖尿病患者[123],以及癌細胞轉移的機制和時間點[124]。
有關胰臟癌的早期診斷仍有正在進行的研究[66][67]。例如,歐洲遺傳性胰腺炎和家族性胰臟腺癌(EUROPAC)試驗就試圖釐清常規篩檢是否適用於有胰臟癌家族史和遺傳性胰臟腺癌的人[125]。目前已有證據顯示新發糖尿病(new onset diabetes)可能為胰臟癌的徵兆,這一發現,或許能改善現有的診斷和篩檢方法,進而加以預防[123][126]。
另一項研究重點是評估腹腔鏡手術的效果是否能超越胰十二指腸切除術,特別是復元時間的差異評估[127]。不可逆性电穿孔(電燒手術)是目前相對常用的燒蝕手術。在病灶尚未擴散的前提下,可有效縮小腫瘤及延長患者存活時間。此類手術適用於生長於胰主要血管以外的腫瘤,以避免造成血管相關的傷害[128][129]。然而單獨進行手術的效果不佳,因此通常會同時配合化療及放射化療,此種療法稱為輔助治療(Adjuvant Therapy)。有關輔助療法的預後仍有爭論[2]。後來的試驗又於上述的輔助療法之外,給予其他藥物,目前已知最有效的藥物為FOLFIRINOX[130]。
新藥物的研發也在持續進行中[45][131]。有些試圖針對癌細胞的分子途徑進行靶向治疗[132][133][134],或降低癌幹細胞的抗性[79][135],還有研究嘗試改變腫瘤以外的基質及微環境,以降低癌細胞的增殖和轉移活性[134][135][136][137][138]。更前瞻的研究還使用了免疫療法,如溶瘤病毒[139][140]。
去世名人
东方
傅達仁1933—2018:台湾电视公司(台视)体育主播,安乐死
戴振耀1948—2017:台湾前农委会副主委
竹田圭吾1964—2016:新闻周刊日本区总编辑
坂東三津五郎1956—2015:日本歌舞伎宗师
夏八木勋1939—2013:日本演员、声优
西方
艾瑞莎·弗兰克林1942—2018:美国「灵魂歌后」、「灵魂乐第一夫人」
乔尔·侯布匈1945—2018:法国厨师、餐厅经营者
约拿单·高德1960—2018:美国美食评论家
艾倫·瑞克曼1946—2016:英国电视剧、电影演员,1996年艾美奖、金球奖得主
史蒂夫·乔布斯1955—2011:美国苹果公司联合创办人
盧奇亞諾·帕華洛帝1935—2007:意大利籍世界三大男高音之一
參見
- 胰臟
- 胃腸癌
- 胰腺癌行動協會
- 勒斯特加滕胰腺癌研究基金會
- 患胰腺癌人物列表
注释
^ 本文將「pancreatic adenocarcinoma」翻為胰臟腺癌。在中國大陸與海外華人社會中,胰腺即為胰脏(pancreas)[21][22][23],因此在這些地區,胰腺癌即為胰脏癌(pancreatic cancer),而發生於胰脏的腺癌則是胰臟癌的其中的一種形式,即胰腺腺癌(pancreatic adenocarcinoma)。台灣、港澳、星馬地區則一般稱呼為胰脏[24][25][26],胰腺癌一詞在這些地區則可能意義不清。為避免歧義,本文統一採用胰脏腺癌或胰腺腺癌。
參考文獻
^ 1.01.11.21.31.41.51.6 Pancreatic Cancer Treatment (PDQ®) Patient Version. National Cancer Institute. National Institutes of Health. 2014-04-17 [2014-06-08].
^ 2.002.012.022.032.042.052.062.072.082.092.102.112.122.132.142.152.162.172.182.192.202.212.222.232.242.252.262.272.282.29 Ryan DP, Hong TS, Bardeesy N. Pancreatic adenocarcinoma (PDF). N. Engl. J. Med. September 2014, 371 (11): 1039–49. PMID 25207767. doi:10.1056/NEJMra1404198. (原始内容 (PDF)存档于2014年12月26日).
^ 3.003.013.023.033.043.053.063.073.083.093.103.113.123.133.143.153.163.173.183.193.203.213.223.233.243.253.263.273.28 Wolfgang CL, Herman JM, Laheru DA, Klein AP, Erdek MA, Fishman EK, Hruban RH. Recent progress in pancreatic cancer. CA: A Cancer Journal for Clinicians. September 2013, 63 (5): 318–48. PMC 3769458. PMID 23856911. doi:10.3322/caac.21190.
^ 4.04.14.24.34.44.54.64.74.84.9 Vincent A, Herman J, Schulick R, Hruban RH, Goggins M. Pancreatic cancer (PDF). Lancet. August 2011, 378 (9791): 607–20. PMID 21620466. doi:10.1016/S0140-6736(10)62307-0. (原始内容 (PDF)存档于2015-01-12).
^ 5.05.1 Can pancreatic cancer be prevented?. American Cancer Society. 2014-06-11 [2014-11-13].
^ 6.006.016.026.036.046.056.066.076.086.096.106.116.126.136.146.156.166.176.186.196.20 World Cancer Report 2014. World Health Organization. 2014. Chapter 5.7. ISBN 92-832-0429-8.
^ 7.07.1 Cancer Facts & Figures 2010 (PDF). American Cancer Society. 2010 [2014-12-05]. (原始内容 (PDF)存档于2015-01-14). See p. 4 for incidence estimates, and p. 19 for survival percentages.
^ GBD 2015 Disease and Injury Incidence and Prevalence, Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015.. Lancet. 2016-10-08, 388 (10053): 1545–1602. PMC 5055577. PMID 27733282. doi:10.1016/S0140-6736(16)31678-6.
^ 9.09.1 GBD 2015 Mortality and Causes of Death, Collaborators. Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015.. Lancet. 2016-10-08, 388 (10053): 1459–1544. PMID 27733281. doi:10.1016/s0140-6736(16)31012-1.
^ What is Cancer? Defining Cancer. National Cancer Institute, National Institutes of Health. 2014-03-07 [2014-12-05].
^ 11.0011.0111.0211.0311.0411.0511.0611.0711.0811.0911.1011.1111.1211.1311.1411.1511.1611.1711.1811.1911.2011.2111.22 Bond-Smith G, Banga N, Hammond TM, Imber CJ. Pancreatic adenocarcinoma (PDF). BMJ (Clinical research ed.). 2012, 344: e2476. PMID 22592847. doi:10.1136/bmj.e2476. (原始内容 (PDF)存档于2015-01-09).
^ Bussom S, Saif MW. Methods and rationale for the early detection of pancreatic cancer. Highlights from the "2010 ASCO Gastrointestinal Cancers Symposium". Orlando, FL, USA. January 22–24, 2010. JOP : Journal of the pancreas. 2010-03-05, 11 (2): 128–30. PMID 20208319.
^ Shahrokni A, Saif MW. Metastatic pancreatic cancer: the dilemma of quality vs. quantity of life. JOP : Journal of the pancreas. 2013-07-10, 14 (4): 391–4. PMID 23846935. doi:10.6092/1590-8577/1663.
^ Bardou M, Le Ray I. Treatment of pancreatic cancer: A narrative review of cost-effectiveness studies. Best practice & research. Clinical gastroenterology. December 2013, 27 (6): 881–92. PMID 24182608. doi:10.1016/j.bpg.2013.09.006.
^ Pancreatic Cancer Research Fund, 2015
^ Hariharan D, Saied A, Kocher HM. Analysis of mortality rates for pancreatic cancer across the world. HPB. 2008, 10 (1): 58–62. PMC 2504856. PMID 18695761. doi:10.1080/13651820701883148.
^ Lifetime Risk of Developing or Dying From Cancer. American Cancer Society. 2014-10-01 [2014-12-01]. 前三名因性別不同而排名不同,包含女性的乳癌,及男性的攝護腺癌。
^ 18.018.1 Pancreatic Cancer Treatment (PDQ®) Health Professional Version. National Cancer Institute. National Institutes of Health. 2014-02-21 [2014-11-24]. "The highest cure rate occurs if the tumor is truly localized to the pancreas; however, this stage of disease accounts for less than 20% of cases. In cases with localized disease and small cancers (<2 cm) with no lymph node metastases and no extension beyond the capsule of the pancreas, complete surgical resection is associated with an actuarial five-year survival rate of 18% to 24%."
^ Harris, RE. Epidemiology of pancreatic cancer. Epidemiology of Chronic Disease. Jones & Bartlett. 2013: 181–190. ISBN 978-0-7637-8047-0.
^ 20.020.120.220.320.420.520.6 Öberg K, Knigge U, Kwekkeboom D, Perren A. Neuroendocrine gastro-entero-pancreatic tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology. October 2012,. 23 Suppl 7: vii124–30. PMID 22997445. doi:10.1093/annonc/mds295. (Table 5 outlines the proposed TNM staging system for PanNETs.)
^ 胡建昆,周总光,杨开清. 胰腺的应用解剖. 世界华人消化杂志. 2001, 9 (7): 826-829.
^ Cancer Council NSW. 胰腺癌. Cancer Australia. [2017年2月12日].
^ 美國癌症協會American Cancer Society & WebMD. 胰腺癌 深藏不露的危機. 亞美醫師協會. [2017年2月12日].
^ 石宜銘,章明珠. 希望之路:面對胰臟癌. 台北: 財團法人癌症希望基金會. 2015.
^ 衛生署衞生防護中心 監測及流行病學處. 非傳染病直擊:動起來減低患癌風險 (PDF). 衛生署衞生防護中心 監測及流行病學處. [2017年2月12日].
^ 新加坡癌症登记处. 癌症统计数据 (PDF). 新加坡癌症登记处. 2013年 [2017年2月12日]. [永久失效連結]
^ Ryan DP, Hong TS, Bardeesy N. Pancreatic adenocarcinoma (PDF). N. Engl. J. Med. September 2014, 371 (11): 1039–49. PMID 25207767. doi:10.1056/NEJMra1404198. (原始内容 (PDF)存档于2014年12月26日).
^ Govindan R. DeVita, Hellman, and Rosenberg's Cancer: Cancer: Principles & Practice of Oncology 9th. Lippincott Williams & Wilkins. 2011. Chapter 35: Cancer of the Pancreas: Surgical Management. ISBN 978-1-4511-0545-2. Online edition, with updates to 2014
^ Handbook of Pancreatic Cancer. New York: Springer. 2009: 288 [2016-06-12]. ISBN 978-0-387-77497-8.
^ 30.030.130.2 Tobias JS, Hochhauser D. Cancer and its Management 7th. 2014: 297. ISBN 978-1-118-46871-5.
^ 31.031.131.2 Types of Pancreas Tumors. The Sol Goldman Pancreas Cancer Research Center. Johns Hopkins Medicine. 2012 [2014-11-18].
^ Farrell JJ, Fernández-del Castillo C. Pancreatic cystic neoplasms: management and unanswered questions. Gastroenterology. June 2013, 144 (6): 1303–15. PMID 23622140. doi:10.1053/j.gastro.2013.01.073.
^ 33.033.133.2 PanNET在此處採用2010年WHO消化系統疾病分類指引[1]的名稱。以往PanNETs曾代表不同的意義,至今仍常用來泛稱胰臟內分泌腫瘤。參見:Klimstra DS, Modlin IR, Coppola D, Lloyd RV, Suster S. The pathologic classification of neuroendocrine tumors: a review of nomenclature, grading, and staging systems (PDF). Pancreas. August 2010, 39 (6): 707–12. PMID 20664470. doi:10.1097/MPA.0b013e3181ec124e.
^ 34.034.134.234.334.434.534.634.7 Burns WR, Edil BH. Neuroendocrine pancreatic tumors: guidelines for management and update. Current treatment options in oncology. March 2012, 13 (1): 24–34. PMID 22198808. doi:10.1007/s11864-011-0172-2.
^ The Medical Subject Headings indexing system refers to "islet cell carcinoma", which is subdivided into gastrinoma, glucagonoma, somatostatinoma and VIPoma. See: 2014 MeSH tree at "Pancreatic Neoplasms [C04.588.322.475]" 16 October 2014
^ 36.036.1 Islet Cell Tumors of the Pancreas / Endocrine Neoplasms of the Pancreas. The Sol Goldman Pancreas Cancer Research Center. Johns Hopkins Medicine. 2012 [2015-01-05].
^ 37.037.137.237.337.437.537.6 De La Cruz MS, Young AP, Ruffin MT. Diagnosis and management of pancreatic cancer. Am Fam Physician. April 2014, 89 (8): 626–32. PMID 24784121.
^ 38.038.1 Alberts, SR; Goldberg, RM. Chapter 9: Gastrointestinal tract cancers. (编) Casciato, DA; Territo, MC. Manual of clinical oncology. Lippincott Williams & Wilkins. 2009: 188–236. ISBN 978-0-7817-6884-9.
^ Pannala R, Basu A, Petersen GM, Chari ST. New-onset diabetes: a potential clue to the early diagnosis of pancreatic cancer. The Lancet. Oncology. January 2009, 10 (1): 88–95. PMC 2795483. PMID 19111249. doi:10.1016/S1470-2045(08)70337-1.
^ Chapter 15; Pancreas. Manual for Staging of Cancer (PDF) 2nd. American Joint Committee on Cancer. : 95–8. See page 95 for citation regarding "... lesser degree of involvement of bones and brain and other anatomical sites."
^ Sperti C, Moletta L, Patanè G. Metastatic tumors to the pancreas: The role of surgery. World Journal of Gastrointestinal Oncology. 2014-10-15, 6 (10): 381–92. PMC 4197429. PMID 25320654. doi:10.4251/wjgo.v6.i10.381.
^ Causes of pancreatic cancer. NHS Choices. National Health Service, England. 2014-10-07 [2014-12-05].
^ Bosetti C, Lucenteforte E, Silverman DT, Petersen G, Bracci PM, Ji BT, Negri E, Li D, Risch HA, Olson SH, Gallinger S, Miller AB, Bueno-de-Mesquita HB, Talamini R, Polesel J, Ghadirian P, Baghurst PA, Zatonski W, Fontham E, Bamlet WR, Holly EA, Bertuccio P, Gao YT, Hassan M, Yu H, Kurtz RC, Cotterchio M, Su J, Maisonneuve P, Duell EJ, Boffetta P, La Vecchia C. Cigarette smoking and pancreatic cancer: an analysis from the International Pancreatic Cancer Case-Control Consortium (Panc4). Annals of Oncology. July 2012, 23 (7): 1880–8. PMC 3387822. PMID 22104574. doi:10.1093/annonc/mdr541.
^ Peters, ML; Tseng, JF; Miksad, RA. Genetic Testing in Pancreatic Ductal Adenocarcinoma: Implications for Prevention and Treatment.. Clinical therapeutics. 2016-03-31, 38: 1622–35. PMID 27041411. doi:10.1016/j.clinthera.2016.03.006.
^ 45.045.145.2 Reznik R, Hendifar AE, Tuli R. Genetic determinants and potential therapeutic targets for pancreatic adenocarcinoma. Front Physiol. 2014, 5: 87. PMC 3939680. PMID 24624093. doi:10.3389/fphys.2014.00087.
^ Greenhalf W, Grocock C, Harcus M, Neoptolemos J. Screening of high-risk families for pancreatic cancer. Pancreatology. 2009, 9 (3): 215–22. PMID 19349734. doi:10.1159/000210262.
^ Wolfgang CL, Herman JM, Laheru DA, Klein AP, Erdek MA, Fishman EK, Hruban RH. Recent progress in pancreatic cancer. CA: A Cancer Journal for Clinicians. September 2013, 63 (5): 318–48. PMC 3769458. PMID 23856911. doi:10.3322/caac.21190.
^ Pericleous M, Rossi RE, Mandair D, Whyand T, Caplin ME. Nutrition and pancreatic cancer.. Anticancer research. January 2014, 34 (1): 9–21. PMID 24403441.
^ 49.049.149.2 Wolfgang CL, Herman JM, Laheru DA, Klein AP, Erdek MA, Fishman EK, Hruban RH. Recent progress in pancreatic cancer. CA: A Cancer Journal for Clinicians. September 2013, 63 (5): 318–48. PMC 3769458. PMID 23856911. doi:10.3322/caac.21190.
^ Reznik R, Hendifar AE, Tuli R. Genetic determinants and potential therapeutic targets for pancreatic adenocarcinoma. Front Physiol. 2014, 5: 87. PMC 3939680. PMID 24624093. doi:10.3389/fphys.2014.00087.
^ Cancer Facts and Figures 2014 (PDF). American Cancer Society. [2015-01-05]. , p. 19, "Though evidence is still accumulating, consumption of red or processed meat, or meat cooked at very high temperatures, may slightly increase risk."
^ Larsson SC, Wolk A. Red and processed meat consumption and risk of pancreatic cancer: meta-analysis of prospective studies. Br J Cancer. January 2012, 106 (3): 603–7. PMC 3273353. PMID 22240790. doi:10.1038/bjc.2011.585.
^ Fitzgerald, J. Edward F.; White, Matthew J.; Lobo, Dileep N. Courvoisier’s Gallbladder: Law or Sign?. World Journal of Surgery. 2009-04-01, 33 (4): 886–891. ISSN 0364-2313. doi:10.1007/s00268-008-9908-y.
^ Cyrus Piraka; James M. Scheiman. New Diagnostic Imaging Modalities for Pancreatic Disease. Curr Opin Gastroenterol. 2011, 27 (5).
^ 55.055.155.255.3 Seufferlein T, Bachet JB, Van Cutsem E, Rougier P. Pancreatic adenocarcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology. October 2012,. 23 Suppl 7: vii33–40. PMID 22997452. doi:10.1093/annonc/mds224.
^ Cascinu S, Falconi M, Valentini V, Jelic S. Pancreatic cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology. May 2010,. 21 Suppl 5: v55–8. PMID 20555103. doi:10.1093/annonc/mdq165.
^ 57.057.157.2 Staging of pancreatic cancer. American Cancer Society. 2014-06-11 [2014-09-29].
^ 58.058.1 Zyromski, Nicholas J.; Nakeeb, Attila; Lillemoe, Keith D. Silberman, Howard; Silberman, Allan W., 编. Principles and practice of surgical oncology : multidisciplinary approach to difficult problems online. Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins. 2010. Chapter 35. ISBN 978-0-7817-6546-6. 使用|accessdate=需要含有|url=(帮助)
^ 59.059.159.259.3 Neuroendocrine tumors, NCCN Guidelines Version 1.2015 (PDF). NCCN Guidelines. National Comprehensive Cancer Network, Inc. 2014-11-11 [2014-12-25].
^ National Cancer Institute. Pancreatic Neuroendocrine Tumors (Islet Cell Tumors) Treatment (PDQ®) Incidence and Mortality [2]
^ Delpu Y, Hanoun N, Lulka H, Sicard F, Selves J, Buscail L, Torrisani J, Cordelier P. Genetic and epigenetic alterations in pancreatic carcinogenesis. Curr Genomics. 2011, 12 (1): 15–24. PMC 3129039. PMID 21886451. doi:10.2174/138920211794520132.
^ 62.062.1 Lewis MA, Yao JC. Molecular pathology and genetics of gastrointestinal neuroendocrine tumours. Current Opinion in Endocrinology & Diabetes and Obesity. Feb 2014, 21 (1): 22–7. PMID 24310147. doi:10.1097/MED.0000000000000033.
^ Thakker RV, Newey PJ, Walls GV, Bilezikian J, Dralle H, Ebeling PR, Melmed S, Sakurai A, Tonelli F, Brandi ML. Clinical practice guidelines for multiple endocrine neoplasia type 1 (MEN1) (PDF). The Journal of Clinical Endocrinology and Metabolism. September 2012, 97 (9): 2990–3011. PMID 22723327. doi:10.1210/jc.2012-1230.
^ Diet and activity factors that affect risks for certain cancers: Pancreatic cancer section. American Cancer Society. 2012-08-20 [2014-11-04].
^ Pericleous M, Rossi RE, Mandair D, Whyand T, Caplin ME. Nutrition and pancreatic cancer.. Anticancer research. January 2014, 34 (1): 9–21. PMID 24403441.
^ 66.066.1 He XY, Yuan YZ. Advances in pancreatic cancer research: moving towards early detection. World J. Gastroenterol. August 2014, 20 (32): 11241–8. PMC 4145762. PMID 25170208. doi:10.3748/wjg.v20.i32.11241.
^ 67.067.167.2 Okano K, Suzuki Y. Strategies for early detection of resectable pancreatic cancer. World J. Gastroenterol. August 2014, 20 (32): 11230–40. PMC 4145761. PMID 25170207. doi:10.3748/wjg.v20.i32.11230.
^ Stoita A, Penman ID, Williams DB. Review of screening for pancreatic cancer in high risk individuals. World J. Gastroenterol. May 2011, 17 (19): 2365–71. PMC 3103788. PMID 21633635. doi:10.3748/wjg.v17.i19.2365.
^ Gurusamy KS, Kumar S, Davidson BR, Fusai G. Cochrane Database of Systematic Reviews. The Cochrane database of systematic reviews. 2014, 2 (2): CD010244. PMID 24578248. doi:10.1002/14651858.CD010244.pub2.
^ 70.070.1 Mollberg N, Rahbari NN, Koch M, Hartwig W, Hoeger Y, Büchler MW, Weitz J. Arterial resection during pancreatectomy for pancreatic cancer: A systematic review and meta-analysis. Annals of Surgery. 2011, 254 (6): 882–93. PMID 22064622. doi:10.1097/SLA.0b013e31823ac299.
^ 71.071.171.2 Pancreatic adenocarcinoma. NCCN Guidelines Version 1.2015 (PDF). NCCN Guidelines. National Comprehensive Cancer Network, Inc. 2014-12-04 [2014-12-26].
^ Alamo JM, Marín LM, Suarez G, Bernal C, Serrano J, Barrera L, Gómez MA, Muntané J, Padillo FJ. Improving outcomes in pancreatic cancer: key points in perioperative management. World J. Gastroenterol. 2014, 20 (39): 14237–45. PMC 4202352. PMID 25339810. doi:10.3748/wjg.v20.i39.14237.
^ Lopez NE, Prendergast C, Lowy AM. Borderline resectable pancreatic cancer: definitions and management. World J. Gastroenterol. 2014, 20 (31): 10740–51. PMC 4138454. PMID 25152577. doi:10.3748/wjg.v20.i31.10740.
^ Polistina, Francesco; Di Natale, Giuseppe; Bonciarelli, Giorgio; Ambrosino, Giovanni; Frego, Mauro. Neoadjuvant strategies for pancreatic cancer. World Journal of Gastroenterology : WJG. 2014-07-28, 20 (28): 9374–9383. ISSN 1007-9327. PMC 4110569. PMID 25071332. doi:10.3748/wjg.v20.i28.9374.
^ Gillen S, Schuster T, Meyer Zum Büschenfelde C, Friess H, Kleeff J. Preoperative/neoadjuvant therapy in pancreatic cancer: a systematic review and meta-analysis of response and resection percentages. PLoS Med. 2010, 7 (4): e1000267. PMC 2857873. PMID 20422030. doi:10.1371/journal.pmed.1000267.
^ Christians KK, Evans DB. Additional Support for Neoadjuvant Therapy in the Management of Pancreatic Cancer. Ann. Surg. Oncol. 2014, 22 (6): 1755–8. PMID 25519932. doi:10.1245/s10434-014-4307-0.
^ Tsvetkova EV, Asmis TR. Role of neoadjuvant therapy in the management of pancreatic cancer: is the era of biomarker-directed therapy here?. Curr Oncol. 2014, 21 (4): e650–7. PMC 4117630. PMID 25089113. doi:10.3747/co.21.2006.
^ Zhan HX, Xu JW, Wu D, Zhang TP, Hu SY. Pancreatic cancer stem cells: New insight into a stubborn disease. Cancer Lett. 2015, 357 (2): 429–37. PMID 25499079. doi:10.1016/j.canlet.2014.12.004.
^ 79.079.1 Tanase CP, Neagu AI, Necula LG, Mambet C, Enciu AM, Calenic B, Cruceru ML, Albulescu R. Cancer stem cells: Involvement in pancreatic cancer pathogenesis and perspectives on cancer therapeutics. World Journal of Gastroenterology. 2014, 20 (31): 10790–801. PMC 4138459. PMID 25152582. doi:10.3748/wjg.v20.i31.10790.
^ Allen VB, Gurusamy KS, Takwoingi Y, Kalia A, Davidson BR. Diagnostic accuracy of laparoscopy following computed tomography (CT) scanning for assessing the resectability with curative intent in pancreatic and periampullary cancer. Cochrane Database Syst Rev. 2016, 7: CD009323. PMID 27383694. doi:10.1002/14651858.CD009323.pub3.
^ Heinemann V, Haas M, Boeck S. Neoadjuvant treatment of borderline resectable and non-resectable pancreatic cancer.. Annals of Oncology. October 2013, 24 (10): 2484–92. PMID 23852311. doi:10.1093/annonc/mdt239.
^ 82.082.182.2 Thota R, Pauff JM, Berlin JD. Treatment of metastatic pancreatic adenocarcinoma: a review. Oncology (Williston Park, N.Y.). January 2014, 28 (1): 70–4. PMID 24683721.
^ Ryan, DP. Chemotherapy for advanced exocrine pancreatic cancer: Topic 2475, Version 46.0 (subscription required). UpToDate. Wolters Kluwer Health. 2014-07-08 [2014-11-18].
^ Cancer Drug Information: FDA Approval for Erlotinib Hydrochloride. National Cancer Institute. National Institutes of Health. 2013-07-03 [2014-12-05].
^ Borazanci E, Von Hoff DD; Von Hoff, DD. Nab-paclitaxel and gemcitabine for the treatment of people with metastatic pancreatic cancer. Expert Rev Gastroenterol Hepatol. September 2014, 8 (7): 739–47. PMID 24882381. doi:10.1586/17474124.2014.925799.
^ Falconi M, Bartsch DK, Eriksson B, Klöppel G, Lopes JM, O'Connor JM, Salazar R, Taal BG, Vullierme MP, O'Toole D. ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms of the digestive system: Well-differentiated pancreatic non-functioning tumors. Neuroendocrinology. 2012, 95 (2): 120–34. PMID 22261872. doi:10.1159/000335587.
^ Jensen RT, Cadiot G, Brandi ML, de Herder WW, Kaltsas G, Komminoth P, Scoazec JY, Salazar R, Sauvanet A, Kianmanesh R. ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: Functional pancreatic endocrine tumor syndromes. Neuroendocrinology. 2012, 95 (2): 98–119. PMC 3701449. PMID 22261919. doi:10.1159/000335591.
^ Pavel M, Baudin E, Couvelard A, Krenning E, Öberg K, Steinmüller T, Anlauf M, Wiedenmann B, Salazar R. ENETS Consensus Guidelines for the management of patients with liver and other distant metastases from neuroendocrine neoplasms of foregut, midgut, hindgut, and unknown primary. Neuroendocrinology. 2012, 95 (2): 157–76. PMID 22262022. doi:10.1159/000335597.
^ Rossi, Roberta Elisa; Massironi, Sara; Conte, Dario; Peracchi, Maddalena. Therapy for metastatic pancreatic neuroendocrine tumors. Annals of Translational Medicine. 2014-1, 2 (1). ISSN 2305-5839. PMC 4200651. PMID 25332984. doi:10.3978/j.issn.2305-5839.2013.03.01. 请检查|date=中的日期值 (帮助)
^ Nick Mulcahy. FDA Approves Lanreotide for Neuroendocrine Tumors. Medscape Medical News. WebMD LLC. 2014-12-17 [2014-12-25].
^ Everolimus Approved for Pancreatic Neuroendocrine Tumors The ASCO Post. May 15, 2011, Volume 2, Issue 8
^ National Cancer Institute. Cancer Drug Information. FDA Approval for Sunitinib Malate. Pancreatic Neuroendocrine Tumors
^ Tejani, Mohamedtaki Abdulaziz; Saif, Muhammad Wasif. Pancreatic neuroendocrine tumors: does chemotherapy work?. JOP: Journal of the pancreas. 2014-03-10, 15 (2): 132–134. ISSN 1590-8577. PMID 24618436.
^ Text is available electronically (but may require free registration) See: Benson AB, Myerson RJ, Sasson AR. Pancreatic, neuroendocrine GI, and adrenal cancers. Cancer Management: A Multidisciplinary Approach 13th edition 2010.. ISBN 978-0-615-41824-7.
^ Gulenchyn KY, Yao X, Asa SL, Singh S, Law C. Radionuclide therapy in neuroendocrine tumours: A systematic review. Clinical Oncology. 2012, 24 (4): 294–308. PMID 22221516. doi:10.1016/j.clon.2011.12.003.
^ Vinik AI. Advances in Diagnosis and Treatment of Pancreatic Neuroendocrine Tumors (PNETS). Endocrine Practice. 2014, 20 (11): 1–23. PMID 25297671. doi:10.4158/EP14373.RA.
^ Kwekkeboom DJ, de Herder WW, van Eijck CH, Kam BL, van Essen M, Teunissen JJ, Krenning EP. Peptide receptor radionuclide therapy in patients with gastroenteropancreatic neuroendocrine tumors. Seminars in Nuclear Medicine. 2010, 40 (2): 78–88. PMID 20113677. doi:10.1053/j.semnuclmed.2009.10.004.
^ Bodei L, Cremonesi M, Kidd M, Grana CM, Severi S, Modlin IM, Paganelli G. Peptide receptor radionuclide therapy for advanced neuroendocrine tumors. Thoracic Surgery Clinics. 2014, 24 (3): 333–49. PMID 25065935. doi:10.1016/j.thorsurg.2014.04.005.
^ Castellano D, Grande E, Valle J, Capdevila J, Reidy-Lagunes D, O'Connor JM, Raymond E. Expert consensus for the management of advanced or metastatic pancreatic neuroendocrine and carcinoid tumors. Cancer Chemotherapy and Pharmacology. 2014, 75 (6): 1099–114. PMID 25480314. doi:10.1007/s00280-014-2642-2.
^ Singh S, Dey C, Kennecke H, Kocha W, Maroun J, Metrakos P, Mukhtar T, Pasieka J, Rayson D, Rowsell C, Sideris L, Wong R, Law C. Consensus Recommendations for the Diagnosis and Management of Pancreatic Neuroendocrine Tumors: Guidelines from a Canadian National Expert Group. Annals of Surgical Oncology. 2014, 22 (8): 2685–99. PMID 25366583. doi:10.1245/s10434-014-4145-0.
^ Palliative or Supportive Care. American Cancer Society. 2014 [2014-08-20].
^ Buanes TA. Pancreatic cancer-improved care achievable. World Journal of Gastroenterology. 2014-08-14, 20 (30): 10405–18. PMC 4130847. PMID 25132756. doi:10.3748/wjg.v20.i30.10405.
^ If treatment for pancreatic cancer stops working. American Cancer Society. 2014-06-11 [2014-08-20]. (原始内容存档于2014-10-22).
^ Arcidiacono PG, Calori G, Carrara S, McNicol ED, Testoni PA. Arcidiacono PG, 编. Celiac plexus block for pancreatic cancer pain in adults. Cochrane Database Syst Rev. 2011, (3): CD007519. PMID 21412903. doi:10.1002/14651858.CD007519.pub2.
^ J. S. Barkin, R. I. Goldberg, G. N. Sfakianakis & J. Levi. Pancreatic carcinoma is associated with delayed gastric emptying. Digestive diseases and sciences. 1986, 31 (3): 265–267. PMID 3004847.
^ Cancer Facts and Figures 2014 (PDF). American Cancer Society. [2015-01-05]. , Table, p. 18, rates adjusted for normal life expectancy
^ Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, Abraham J, Adair T, Aggarwal R, 等. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. December 2012, 380 (9859): 2095–128. PMID 23245604. doi:10.1016/S0140-6736(12)61728-0.
^ 108.0108.1 Siegel, Rebecca L.; Miller, Kimberly D.; Jemal, Ahmedin. Cancer statistics, 2016. CA: a cancer journal for clinicians. 2016-01-01, 66 (1): 7–30. ISSN 1542-4863. PMID 26742998. doi:10.3322/caac.21332.
^ What are the key statistics about pancreatic cancer?. American Cancer Society. 2014-06-11 [2014-11-11].
^ Pancreatic cancer statistics. Cancer Research UK. [2014-12-18]. ; "In 2010, in the UK, the lifetime risk of developing pancreatic cancer is 1 in 73 for men and 1 in 74 for women", noting "The lifetime risk ... has been calculated ... using the 'Current Probability' method; this is a different method used from most other cancer sites since the possibility of having more than one diagnosis of pancreatic cancer over the course of their lifetime is very low"
^ Pancreatic cancer statistics. Cancer Research UK. [2014-10-28].
^ 112.0112.1 Pancreatic cancer: yesterday, today and tomorrow. Future Oncology. 2016-06-01, 12 (16): 1929–1946. ISSN 1479-6694. doi:10.2217/fon-2016-0010.
^ 113.0113.1113.2 Busnardo AC, DiDio LJ, Tidrick RT, Thomford NR. History of the pancreas (PDF). American Journal of Surgery. 1983, 146 (5): 539–50. PMID 6356946. doi:10.1016/0002-9610(83)90286-6.
^ 114.0114.1114.2114.3 Are C, Dhir M, Ravipati L. History of pancreaticoduodenectomy: early misconceptions, initial milestones and the pioneers. HPB. June 2011, 13 (6): 377–84. PMC 3103093. PMID 21609369. doi:10.1111/j.1477-2574.2011.00305.x.
^ 115.0115.1 Cameron JL, Riall TS, Coleman J, Belcher KA. One thousand consecutive pancreaticoduodenectomies. Annals of Surgery. July 2006, 244 (1): 10–5. PMC 1570590. PMID 16794383. doi:10.1097/01.sla.0000217673.04165.ea.
^ Govindan R. DeVita, Hellman, and Rosenberg's Cancer: Cancer: Principles & Practice of Oncology 9th. Lippincott Williams & Wilkins. 2011. Chapter 35: Cancer of the Pancreas: Surgical Management. ISBN 978-1-4511-0545-2. Online edition, with updates to 2014
^ Fernández-del Castillo C, Morales-Oyarvide V, McGrath D, Wargo JA, Ferrone CR, Thayer SP, Lillemoe KD, Warshaw AL. Evolution of the Whipple procedure at the Massachusetts General Hospital. Surgery. September 2012, 152 (3 Suppl 1): S56–63. PMC 3806095. PMID 22770961. doi:10.1016/j.surg.2012.05.022.
^ Wolpin BM, Stampfer MJ. Defining determinants of pancreatic cancer risk: are we making progress?. J. Natl. Cancer Inst. July 2009, 101 (14): 972–3. PMID 19561317. doi:10.1093/jnci/djp182.
^ What's new in pancreatic cancer research and treatment?. American Cancer Society. 2014-06-11 [2014-07-17].
^ Pancreatic cancer research. Cancer Research UK. [2014-07-17].
^ Australian Pancreatic Genome Initiative. Garvan Institute. [2014-07-17].
^ Biankin AV, Waddell N, Kassahn KS, Gingras MC, Muthuswamy LB, Johns AL, Miller DK, Wilson PJ, 等. Pancreatic cancer genomes reveal aberrations in axon guidance pathway genes. Nature. November 2012, 491 (7424): 399–405. Bibcode:2012Natur.491..399.. PMC 3530898. PMID 23103869. doi:10.1038/nature11547.
^ 123.0123.1 Pannala R, Basu A, Petersen GM, Chari ST. New-onset diabetes: a potential clue to the early diagnosis of pancreatic cancer. Lancet Oncol. January 2009, 10 (1): 88–95. PMC 2795483. PMID 19111249. doi:10.1016/S1470-2045(08)70337-1.
^ Graham JS, Jamieson NB, Rulach R, Grimmond SM, Chang DK, Biankin AV. Pancreatic cancer genomics: where can the science take us?. Clin. Genet. November 2014, 88 (3): 213–9. PMID 25388820. doi:10.1111/cge.12536.
^ About EUROPAC. European Registry of Hereditary Pancreatitis and Familial Pancreatic Cancer (EUROPAC). University of Liverpool. [2014-07-17]. (原始内容存档于2014-07-26).
^ Bruenderman EH, Martin RC. High-risk population in sporadic pancreatic adenocarcinoma: guidelines for screening. The Journal of surgical research. 2014-10-13, 194 (1): 212–219. PMC 4559279. PMID 25479908. doi:10.1016/j.jss.2014.06.046.
^ Subar D, Gobardhan PD, Gayet B. Laparoscopic pancreatic surgery. Best Practice & Research Clinical Gastroenterology. 2014, 28 (1): 123–32. doi:10.1016/j.bpg.2013.11.011.
^ Weiss MJ, Wolfgang CL. Irreversible electroporation: a novel pancreatic cancer therapy. Current Problems in Cancer. 2013, 37 (5): 262–5. PMID 24331180. doi:10.1016/j.currproblcancer.2013.10.002.
^ Moir J, White SA, French JJ, Littler P, Manas DM. Systematic review of irreversible electroporation in the treatment of advanced pancreatic cancer. European journal of surgical oncology : the journal of the European Society of Surgical Oncology and the British Association of Surgical Oncology. December 2014, 40 (12): 1598–1604. PMID 25307210. doi:10.1016/j.ejso.2014.08.480.
^ Hackert, Thilo; Sachsenmaier, Milena; Hinz, Ulf; Schneider, Lutz; Michalski, Christoph W.; Springfeld, Christoph; Strobel, Oliver; Jäger, Dirk; Ulrich, Alexis. Locally Advanced Pancreatic Cancer. Annals of Surgery: 457–463. doi:10.1097/sla.0000000000001850.
^ Al Haddad AH, Adrian TE. Challenges and future directions in therapeutics for pancreatic ductal adenocarcinoma. Expert Opin Investig Drugs. November 2014, 23 (11): 1499–515. PMID 25078674. doi:10.1517/13543784.2014.933206.
^ Adiseshaiah, Pavan P.; Crist, Rachael M.; Hook, Sara S.; McNeil, Scott E. Nanomedicine strategies to overcome the pathophysiological barriers of pancreatic cancer. Nature Reviews Clinical Oncology. 2016, 13 (12): 750–765. ISSN 1759-4774. PMID 27531700. doi:10.1038/nrclinonc.2016.119.
^ Kleger A, Perkhofer L, Seufferlein T. Smarter drugs emerging in pancreatic cancer therapy. Ann. Oncol. July 2014, 25 (7): 1260–70. PMID 24631947. doi:10.1093/annonc/mdu013.
^ 134.0134.1 Tang SC, Chen YC. Novel therapeutic targets for pancreatic cancer. World Journal of Gastroenterology. August 2014, 20 (31): 10825–44. PMC 4138462. PMID 25152585. doi:10.3748/wjg.v20.i31.10825.
^ 135.0135.1 Schober M, Jesenofsky R, Faissner R, Weidenauer C, Hagmann W, Michl P, Heuchel RL, Haas SL, Löhr JM. Desmoplasia and chemoresistance in pancreatic cancer. Cancers (Basel). 2014, 6 (4): 2137–54. PMC 4276960. PMID 25337831. doi:10.3390/cancers6042137.
^ Rossi ML, Rehman AA, Gondi CS. Therapeutic options for the management of pancreatic cancer. World J. Gastroenterol. 2014, 20 (32): 11142–59. PMC 4145755. PMID 25170201. doi:10.3748/wjg.v20.i32.11142.
^ Neesse A, Krug S, Gress TM, Tuveson DA, Michl P. Emerging concepts in pancreatic cancer medicine: targeting the tumor stroma. Onco Targets Ther. 2013, 7: 33–43. PMC 3872146. PMID 24379681. doi:10.2147/OTT.S38111.
^ Heinemann V, Reni M, Ychou M, Richel DJ, Macarulla T, Ducreux M. Tumour-stroma interactions in pancreatic ductal adenocarcinoma: rationale and current evidence for new therapeutic strategies. Cancer Treat. Rev. February 2014, 40 (1): 118–28. PMID 23849556. doi:10.1016/j.ctrv.2013.04.004.
^ Fong Y, Ady J, Heffner J, Klein E. Oncolytic viral therapy for pancreatic cancer: current research and future directions. Oncolytic Virotherapy. 2014: 35. doi:10.2147/OV.S53858.
^ Pavelic J. Editorial: combined cancer therapy. Curr. Pharm. Des. October 2014, 20 (42): 6511–2. PMID 25341927. doi:10.2174/1381612820666140826154834.
外部連結
| 分類 |
|
|---|---|
| 外部資源 |
|
维基共享资源中相关的多媒体资源:胰腺癌 |
开放式目录计划中和胰腺癌相关的内容
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||
|




