自由基
自由基(英語:Free Radical),又称游离基,是指化合物的分子在光热等外界条件下,共价键发生均裂而形成的具有不成对电子的原子或基团。在书写时,一般在原子符号或者原子团符号旁边加上一个“·”表示没有成对的电子。如氢自由基(H·,即氢原子)、氯自由基(Cl·,即氯原子)、氫氧自由基(OH·),甲基自由基(CH3·)和四甲基哌啶氧自由基等。[1]自由基极易发生反应(如二聚反应、夺氢反应、氧化反应、歧化反应等)。自由基可以是带正电荷,负电荷或者不带电荷。虽然金属以及它们的离子或者它们的络合物有不成对的电子,但按照常规习惯定义不算是自由基。[2]
除了极个别情况,大多数的未成对电子形成的自由基都具有较高的化学活性。
自由基反应在燃烧、大气化学、聚合反应、等离子体化学、生物化学和其他各种化学学科中扮演很重要的角色。在化学生物学当中,过氧化物和一氧化氮调节着许多生物过程比如控制血管张力。这样的自由基可以作为一种称为氧化还原信号当中的信使。自由基可被溶剂笼包围。
目录
1 发展历史
2 反应式中自由基的描述
3 形成
4 燃烧
5 聚合
6 大氣中的自由基
7 参考资料
8 参阅
发展历史
历史上第一个被发现和证实的自由基是由摩西·冈伯格在1900年于密歇根大学发现的三苯甲基自由基。

摩西·冈伯格(1866-1947),自由基化学的奠基人
历史上,词组“自由基”是用来命名作为连接分子的不同部分, 特别是当它们在反应过程中保持不变的时候。这些我们现在称为:官能团。比如,甲醇以前认为是由甲基“自由基”和羟基“自由基”所组成的。而甲醇在现在化学的理论中不认为具有自由基,它们既没有不成对的电子也没有活性的电子,因为它们(羟基和甲基)永远都是键合在一起的。但是在质谱当中我们则可以观察到在高能电子的轰击下,甲醇分子被断裂成羟基或者甲基的碎片自由基。
反应式中自由基的描述
在化学方程式当中,自由基最通常被表示为在原子或者分子式旁边的一个点,比如:
- Cl2→UVCl⋅+Cl⋅{displaystyle mathrm {Cl} _{2};{xrightarrow {UV}};{mathrm {Cl} cdot }+{mathrm {Cl} cdot }}
氯气在紫外线的照射下形成氯原子的自由基。
自由基反应机理使用单箭头来描述单电子的转移过程:
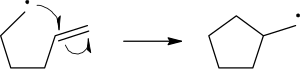
要断裂化学键的裂解,使用类似于鱼钩一样的单箭头(区分于成对电子的双箭头)来表述。这里要提示的是: 断开化学键的第二个电子也是和进攻自由基的单电子成对的, 而这里则不明确的表述出来。
自由基作为反应中间体参与了自由基加成反应和自由基取代反应。 含有自由基的链式反应可以通常被分割成三个不同的过程:“链引发”,“链增长”,“链终止”。
链引发阶段,反应中呈现自由基的净增长。它可以像反应1一样从稳定的形态来生成自由基,也可以是从自由基的形成反应当中来生成更多的自由基。
链增长阶段,反应当中生成了大量自由基,而自由基的总数量是保持不变的。
链终止阶段,反应总体呈现了自由基的净减少。两种自由基互相形成一种更稳定的物质, 比如:2Cl·→ Cl2
例如:甲烷和氯气取代反应的历程[3]
链引发:氯分子在光的作用下,分解成两个氯原子(氯自由基)。从而引发反应
- Cl2→hv2Cl⋅{displaystyle mathrm {Cl} _{2},{xrightarrow {hv}},mathrm {2Cl} cdot }
- Cl2→hv2Cl⋅{displaystyle mathrm {Cl} _{2},{xrightarrow {hv}},mathrm {2Cl} cdot }
链增长:极活泼的Cl·夺取甲烷分子中的一个氢原子,生成甲基自由基(CH3·)和氯化氢。活泼的CH3·自由基立即再与氯分子反应,生成氯甲烷并生成一个新的自由基(Cl·)。该自由基又重新与CH4反应。如此反复循环,引起连锁反应。
- CH4+Cl⋅→CH3⋅+HCl{displaystyle mathrm {CH} _{4}mathrm {+Cl} cdot ,rightarrow ,mathrm {CH} _{3}cdot mathrm {+HCl} }
- CH3⋅+Cl:Cl→CH3Cl+Cl⋅{displaystyle mathrm {CH} _{3}cdot mathrm {+Cl:Cl} ,rightarrow ,mathrm {CH} _{3}mathrm {Cl+Cl} cdot }
- CH4+Cl⋅→CH3⋅+HCl{displaystyle mathrm {CH} _{4}mathrm {+Cl} cdot ,rightarrow ,mathrm {CH} _{3}cdot mathrm {+HCl} }
链终止:当反应中的CH3Cl浓度增高,Cl·游离基将与CH3Cl生成CH2Cl·,并按上述类似过程生成CH2Cl2。进而生成CHCl3、CCl4等。当烷烃消耗完后,Cl·和其自身碰撞的机会增加,生成Cl2分子,其他自由基也可以相互结合生成稳定的分子,反应便告终止。
- Cl⋅+Cl⋅→Cl2{displaystyle mathrm {Cl} cdot mathrm {+Cl} cdot ,rightarrow ,mathrm {Cl} _{2}}
- CH3⋅+CH3⋅→CH3CH3{displaystyle mathrm {CH} _{3}cdot mathrm {+CH} _{3}cdot ,rightarrow ,mathrm {CH} _{3}mathrm {CH} _{3}}
- Cl⋅+Y⋅→YCl(Y=CH3⋅,CH2Cl⋅,CHCl2⋅,CCl3⋅){displaystyle mathrm {Cl} cdot mathrm {+Y} cdot ,rightarrow ,mathrm {YCl} ,,,mathrm {(Y=} mathrm {CH} _{3}cdot ,mathrm {CH} _{2}mathrm {Cl} cdot ,mathrm {CHCl} _{2}cdot ,mathrm {CCl} _{3}cdot mathrm {)} }
- Cl⋅+Cl⋅→Cl2{displaystyle mathrm {Cl} cdot mathrm {+Cl} cdot ,rightarrow ,mathrm {Cl} _{2}}
形成
自由基的形成可以是由于共价键的均裂,其过程需要较高的能量。比如一个H2分子转化为2H·需要ΔH∘=+435kJ/mol{displaystyle Delta mathrm {H} ^{circ }mathrm {=} +mathrm {435kJ} /mathrm {mol} }


然而,链增长过程是一个非常剧烈的放热反应。这里需要注意的是,虽然自由基离子也是存在的,但是大多数的物质都是电中性的。
自由基还可以通过一个原子或者分子的氧化还原过程来形成。
燃烧
燃烧是最常见的自由基反应。氧分子是一种稳定的双自由基,表示为·O-O,因为电子自旋平行,氧分子很稳定。当稳定基态氧分子(三线态氧)激发后,形成极度活泼的的单线态氧。为了使燃烧进行,必须跨越能垒。能垒的跨越需要较高的温度。三线态氧到单线态氧的转换是禁止的(違反自然法則)。
聚合
除了燃燒反應以外,很多聚合反應都涉及自由基。很多塑料和其他聚合物都是由自由基聚合反應所形成。
大氣中的自由基
参考资料
^ 周公度主编. 化学词典. 北京: 化学工业出版社. 2010: 62. ISBN 978-7-122-07817-9.
^ Red Book, IUPAC Recommendations 2005 Nomenclature of Inorganic Chemistry p.66, Formulae of radicals
^ 齐欣、高鸿宾主编. 有机化学简明教程. 天津: 天津大学出版社. 2011: 21. ISBN 9787561839713.
参阅
- 自由基的命名法(C-081,C-082)
- 自由基名称表
- 化學捕捉






